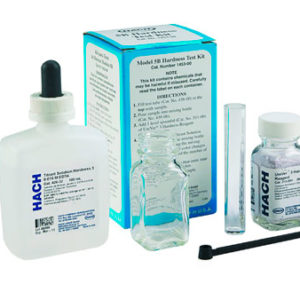
Se define la dureza total del agua como la cantidad de sales de elementos alcalino-térreos (berilio, magnesio, calcio, estroncio, bario y radio) presentes en el agua y que normalmente se asocia a la formación de incrustaciones calcáreas. Si bien el concepto de dureza incluye diversos elementos, en la práctica, la dureza de un agua se corresponde únicamente con la cantidad de calcio y magnesio existentes. En este sentido destaca la importancia del magnesio en la formación de incrustaciones calcáreas ya que habitualmente se tiende a asociar las incrustaciones (cal) únicamente con el calcio presente en el agua y generalmente todas las incrustaciones están constituidas por sales tanto de calcio como de magnesio. El calcio y el magnesio, que forman la dureza del agua, se hallan disueltos en el agua conjuntamente con otros iones como sodio, cloruro, nitrato, sulfato y bicarbonato. En forma particular, los iones que intervienen en la formación de las incrustaciones de cal son el calcio y el magnesio así como el ión bicarbonato, los cuales presentan un equilibrio químico que veremos a continuación. El bicarbonato cálcico, Ca(CO3H)2, y el magnésico, Mg(CO3H)2, son solubles en agua y, por consiguiente, se hallan disuelto en ella en forma de iones; estos compuestos, no obstante, presentan un equilibrio químico que en determinadas condiciones puede conducir a la formación de un precipitado sólido de carbonato cálcico (en el caso del calcio), conocido como cal:  (La reacción del bicarbonato de magnesio es similar aunque el producto que precipita es el hidróxido de magnesio. Para simplificar la explicación se hará únicamente referencia a la precipitación de las sales de calcio). Este equilibrio, que va a regular la formación de las incrustaciones de cal, se puede desplazar fácilmente en función de la concentración de anhídrido carbónico (CO2), como veremos a continuación. El anhídrido carbónico CO2 es un gas y, por ello, su solubilidad en el agua depende la temperatura. Cuando el agua se calienta (en un calentador, por ejemplo) el CO2 tiende a desprenderse disminuyendo su concentración en el agua. Cuando esto ocurre el equilibrio se desplaza hacia la derecha en el sentido necesario para producir más CO2 para compensar el que se pierde (principio de Langelier), pero a la vez que produce más CO2 también se forma como consecuencia mayor cantidad de carbonato cálcico que, al ser insoluble, precipita como “CAL”
(La reacción del bicarbonato de magnesio es similar aunque el producto que precipita es el hidróxido de magnesio. Para simplificar la explicación se hará únicamente referencia a la precipitación de las sales de calcio). Este equilibrio, que va a regular la formación de las incrustaciones de cal, se puede desplazar fácilmente en función de la concentración de anhídrido carbónico (CO2), como veremos a continuación. El anhídrido carbónico CO2 es un gas y, por ello, su solubilidad en el agua depende la temperatura. Cuando el agua se calienta (en un calentador, por ejemplo) el CO2 tiende a desprenderse disminuyendo su concentración en el agua. Cuando esto ocurre el equilibrio se desplaza hacia la derecha en el sentido necesario para producir más CO2 para compensar el que se pierde (principio de Langelier), pero a la vez que produce más CO2 también se forma como consecuencia mayor cantidad de carbonato cálcico que, al ser insoluble, precipita como “CAL” 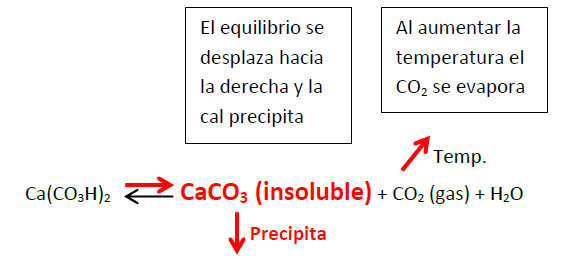 Como consecuencia de este equilibrio, las incrustaciones calcáreas normalmente siempre se producirán en los puntos de mayor temperatura del circuito: calentadores de agua, intercambiadores de calor, etc.
Como consecuencia de este equilibrio, las incrustaciones calcáreas normalmente siempre se producirán en los puntos de mayor temperatura del circuito: calentadores de agua, intercambiadores de calor, etc.